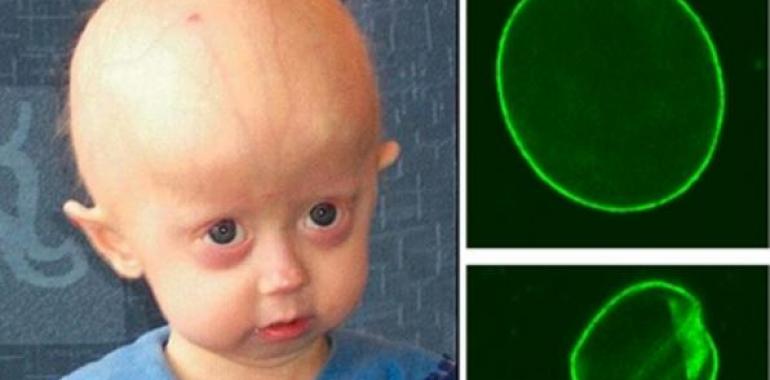
Un equipo español ha descrito cómo se acelera la calcificación en los vasos sanguíneos en el síndrome de envejecimiento prematuro Hutchinson-Gilford o progeria, una enfermedad genética que afecta a uno de cada 4-8 millones de nacidos. No existe cura y los niños fallecen a una edad media de 13 años.
Científicos del Centro Nacional de Investigaciones Cardiovasculares (CNIC) han descubierto en un modelo animal que el déficit en la producción de pirofosfato provoca calcificación vascular excesiva, uno de los síntomas más importantes del síndrome de envejecimiento prematuro Hutchinson-Gilford (HGPS), la también llamada progeria. El exceso de calcio en la pared arterial es también una anomalía típica del envejecimiento fisiológico que se asocia con elevada morbimortalidad en la población general.
El HGPS es una enfermedad genética rara que afecta solo a uno de entre cuatro y ocho millones de nacimientos. Está causada por una mutación espontánea que afecta a un alelo del gen LMNA (proteína lamina A/C) y provoca la síntesis de una proteína anómala, denominada progerina, como consecuencia del procesamiento incorrecto del ARN mensajero.
La calcificación hace que la mayoría de los pacientes de progeria mueran por infarto de miocardio o ictus a una edad de 13 años
Un nuevo estudio que se publica mañana en la edición impresa de Circulation, una de las revistas líderes en el área cardiovascular, apunta a una posible terapia para bloquear el depósito de calcio en la pared de las arterias.
Esta calcificación multiplica el riesgo de enfermedad cardiovascular y la mayoría de los pacientes de progeria acaban falleciendo por infarto de miocardio o ictus cerebral a una edad media de solo 13 años.
Los investigadores dirigidos por el Dr. Vicente Andrés, director del Departamento de Fisiopatología Cardiovascular Molecular y Genética del CNIC, han descrito por primera vez los mecanismos que provocan calcificación vascular en un modelo de HGPS en ratón que recapitula los síntomas principales de la enfermedad humana. En el trabajo también ha colaborado el equipo del laboratorio del Dr. Carlos López–Otín, de la Universidad de Oviedo, uno de los mayores expertos de esta patología a nivel mundial.
Los autores demuestran que la aorta y sangre de los ratones ‘progéricos’ acumula menor cantidad de pirofosfato extracelular, un potente inhibidor de la calcificación vascular. Esto se atribuye a diversos mecanismos. El primero es que existe una menor disponibilidad de su sustrato, el ATP, asociada a disfunción mitocondrial. El segundo, que aumenta la actividad de la fosfatasa alcalina, una enzima responsable de la degradación de pirofosfato.
El equipo del Dr. Andrés ha demostrado que el tratamiento crónico con pirofosfato inhibe el depósito de calcio en las arterias de ratones afectados por la enfermedad.
¿Extrapolable a humanos?
El siguiente paso, para saber si el hallazgo se puede trasladar a humanos, sería comprobar que dicho mecanismo también se produce en los niños afectados por la enfermedad, es decir, que la sangre y arterias de estos enfermos también acumula menos pirofosfato. Si esto es así, “se podría comprobar si los bisfosfonatos, análogos del pirofosfato, consiguen el mismo efecto terapéutico en los niños”, explica el Dr. Andrés.
Las alteraciones observadas pueden, además, contribuir a la calcificación ósea y a la rigidez de las articulaciones
El trabajo ha recibido el premio al mejor póster de investigación básica en el 7thInternational Scientific Workshop sobre Progeria que se ha celebrado este año en Washington organizado por la Progeria Research Foundation.
El Dr. Villa-Bellosta, primer autor del artículo, explica que “estos hallazgos suponen un nuevo paso para comprender y prevenir la calcificación vascular en niños con HGPS”. Las alteraciones observadas por los investigadores del CNIC pueden, además, contribuir también a la calcificación ósea y a la rigidez de las articulaciones, otros de los síntomas que muestran estos pacientes, reconocidos por su peculiar aspecto físico asociado al envejecimiento prematuro.
Estudios recientes han demostrado la acumulación de pequeñas cantidades de progerina durante el envejecimiento normal. Esto podría estar asociado al acortamiento de telómeros que ocurre en el envejecimiento fisiológico y que se acelera en los pacientes de HGPS.
“Estos estudios sugieren mecanismos comunes en progeria y envejecimiento normal. Aunque en ausencia de la mutación causante de la HGPS se producen cantidades pequeñas de progerina, su alta toxicidad puede contribuir al deterioro del sistema cardiovascular durante el envejecimiento normal”, apunta el Dr. Andrés.
El artículo en Circulation viene acompañado de un editorial firmado por la profesora de la Universidad de Harvard Jane A. Leopold. La experta comenta que los resultados de este trabajo podrían ser extrapolables al proceso de calcificación vascular en la población general. También apunta la Dra. Leopold que, aunque el envejecimiento es inevitable los hallazgos de este estudio y otros demuestran que la calcificación vascular se puede prevenir.
Niña afectada con progeria. / Wikipedia