El hombre es el huésped natural de Helicobacter pylori. Esta bacteria fue aislada por primera vez a principios de los años ochenta a partir de especímenes de pacientes con gastritis y úlceras (Warren and Marshall, 1984). H. pylori se encuentra en la superficie de las células gástricas y es la primera bacteria declarada agente carcinógeno tipo I por ser la causa del 63% de los cánceres de estómago (WHO, 2009).
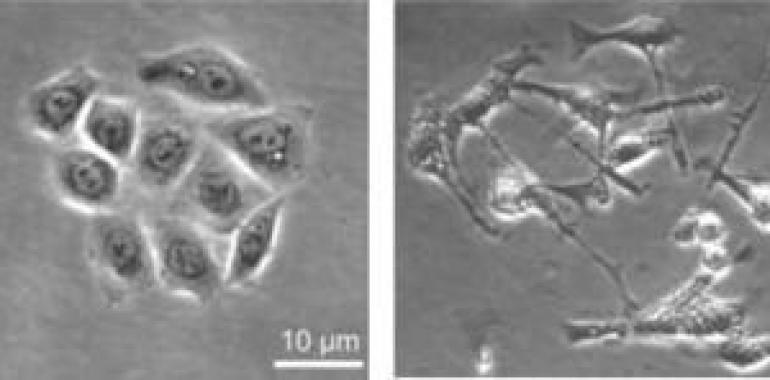
Helicobacter posee un sistema de secreción tipo IV, que actúa como una “jeringa” inyectando proteínas en las células del huésped. Una de estas proteínas es CagA, que es el principal factor de virulencia. CagA, una vez translocada al interior de las células epiteliales gástricas, inicia un complicado “programa de señalización” que conlleva la alteración de varias rutas celulares. En ensayos in vitro, el modelo de estudio más usado es la infección de líneas gástricas como las células de adenocarcinoma gástrico o células AGS. La infección de dichas células con la bacteria provoca disgregación de las células originando un fenotipo denominado de colibrí ó “hummingbird”.
La infección con Helicobacter favorece la activación de FAK por medio de cortactin
El estudio (Tegmeyer et al., 2011) dirigido por el profesor Steffen Backert (actualmente profesor en el National College of Ireland) y en el que han colaborado expertos de varios campos ahonda en la participación de una proteína del huésped, denominada cortactin en el fenotipo de hummingbird, también denominado “cell scattering”. El grupo emergente de la Dra. Narcisa Martínez Quiles, experto en dicha proteína, ha colaborado activamente en este estudio que se inició en el 2006. Cortactin es una oncoproteína que regula el esqueleto de la célula ó citoesqueleto. Cortactin regula la adhesión y la migración celular. Esta proteína es necesaria, por ejemplo, para la formación de las invadopodias, que son unas protusiones de la membrana que penetran la matriz extracelular degradándola y son fundamentales en determinados procesos de metástasis.
Los resultados del estudio revelan información acerca del modo en el que Helicobacter manipula, a nivel molecular, las modificaciones de cortactin, promoviendo la fosforilación de cortactin en serinas e inhibiendo, al mismo tiempo, su fosforilación en tirosinas. Además se demuestra que la infección con el patógeno promueve la interacción de cortactin con la quinasa de adhesión focal (Focal Adhesion Kinase o FAK) activándola. FAK es actualmente una posible diana terapéutica en tratamiento de varios tipos de cáncer.
Cortactin, al ser una proteína esencial en el control del citoesqueleto es diana de varias bacterias patógenas, aparte de Helicobacter. El grupo de la Dra. Martínez Quiles ha demostrado cómo la adhesión de la bacteria Escherichia coli enteropatógena (EPEC), muy relacionada a la causante del reciente brote mortal de E. coli en Alemania (EHEC) también manipula a cortactin (Nieto-Pelegrín et al. 2009).
Por ello la repercusión del estudio no se limita solamente a Helicobacter y a otras bacterias sino que abre nuevas cuestiones que se estudiarán en diversos campos, tales como la migración y adhesión celular, componente esencial de las metástasis tumorales.
FOTO: Figura 1: A la izquierda: células AGS sin infectar con Helicobacter pylori. A la derecha: células AGS infectadas con Helicobacter pylori. Helicobacter induce un fenotipo conocido como fenotipo de colibrí o “hummingbird” (foto derecha), en el que las células están disgregadas y alargadas. El trabajo de Tegmeyer et al. demuestra que Helicobacter manipula a la proteína cortactin a nivel molecular para obtener dicho fenotipo. Modificado de Tegmeyer et al., 2011.